2019年上半年FDA批準了13款創新藥,新藥中多個“首例”
編輯:全球華人抗癌新藥網 來源:全球華人抗癌新藥網 發佈時間:2019-07-03
根據最新FDA藥物評估和研究中心(CDER)的數據統計,本年度FDA總共批準13款創新藥,這壹統計並不包括基因和細胞療法。而FDA生物制劑評估和研究中心(CBER)的數據表明,2019年上半年,FDA還批準了壹款基因療法和壹款疫苗。今年獲批的新藥中有多個“首例”。
首例通過實時腫瘤學審評(RTOR)獲批的新分子實體
2018年FDA創新藥獲批數目能夠創紀錄,不但是新藥研發企業努力的結果,也是FDA銳意改革,加快新藥審評速度的結果。而RTOR,是FDA屬下腫瘤學卓越中心推出的,幫助加快腫瘤學藥物審評速度的壹個重要試點項目。這壹項目允許FDA在正式申請遞交之前獲得關鍵性數據,讓審評團隊能夠更早開始審評過程並且與申請人進行溝通。
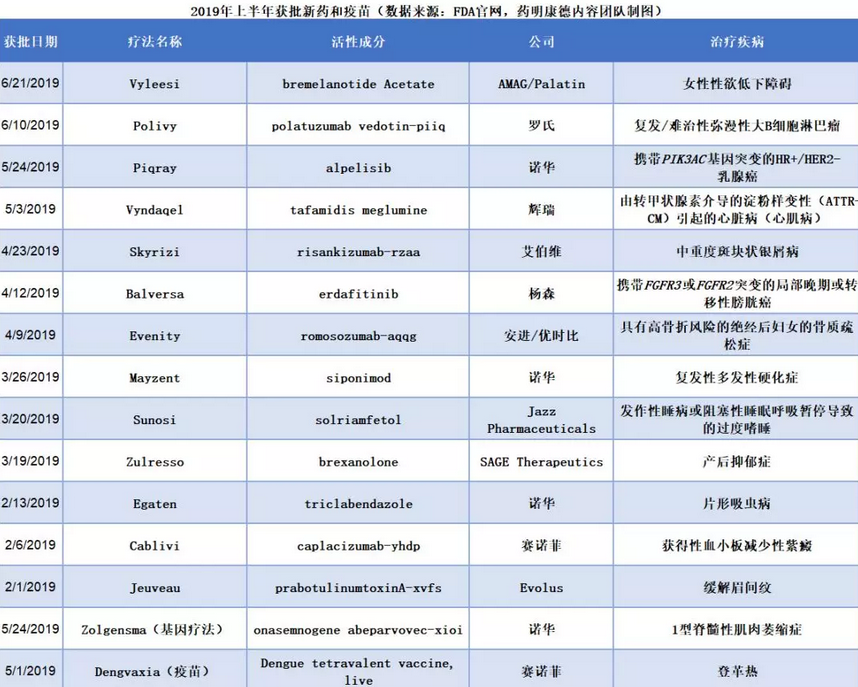
(數據來源:FDA官網)
這壹試點項目已經用於批準多款抗癌療法擴展適應癥。而今年5月,它第壹次被用於批準諾華公司開發的Piqray(alpelisib)。使用RTOR和其它FDA推出的新舉措,Piqray的獲批時間比預計的PDUFA日提前了接近3個月!
將新藥以最快的速度交到患者的手中,離不開監管部門的支持和協助,我們期待FDA繼續進行監管流程的現代化,為造福更多患者助力。
