瑞輝治療白血病新藥Mylotarg終獲FDA批准上市
編輯:全球華人抗癌新藥網 來源:藥明康得 發佈時間:2017-09-11
2017年9月2日,瑞輝(Pfizer)公司宣佈,其新藥Mylotarg(gemtuzumab ozogamicin)得到了美國FDA的批准,用於治療表達CD33抗原的新診斷急性骨髓性白血病(AML)的成人患者。FDA同時也批准該藥物用於治療2歲及以上的CD33陽性AML患者,這些患者經歷復發或對初始治療沒有回應。值得一提的是,Mylotarg是首款包括兒童AML適應症的藥物,也是唯一一款靶向CD33的AML治療方法。
急性骨髓性白血病是一種在骨髓中形成的快速進展的癌症,會導致血液中的白細胞數量增多。根據美國國家癌症研究所(NCI)的統計,今年約有21380人被診斷為AML,還有10590人會死於AML。這一領域還有醫療需求未被滿足。
Mylotarg是一款抗體藥物偶聯物(ADC),含有可以靶向CD33的單克隆抗體和與之連接的細胞毒素卡其黴素(calicheamicin)。CD33是一種在成髓細胞表面表達的抗原,在多達90%的AML患者中都存在。當Mylotarg與CD33抗原結合時,它可以被吸收進細胞,然後在癌細胞內釋放卡其黴素將其殺死。
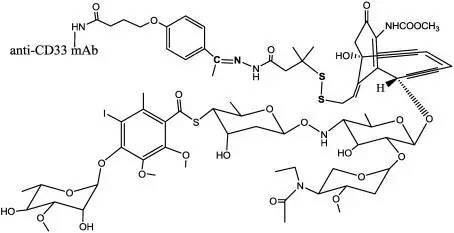
▲Gemtuzumab ozogamicin的分子結構式
Mylotarg與化療聯合的安全性和療效在臨床試驗ALFA-0701中得到證實。這項試驗共有271名CD33陽性的新診斷AML成人患者。他們被隨機分配接受Mylotarg與柔紅黴素(daunorubicin)和阿糖胞苷(cytarabine)聯合治療,或只接受柔紅黴素和阿糖胞苷治療 。結果顯示,接受Mylotarg與化療聯合治療的患者的無事件生存期(event-free survival,EFS)長於那些只接受化療的患者,中位EFS分別為17.3個月和9.5個月(HR=0.56 [95%CI: 0.42-0.76])。
單獨使用Mylotarg的安全性和療效也在兩項獨立的臨床試驗AML-19和MyloFrance-1.1中得到證實。第一項試驗共有237名新診斷的AML患者,他們不能耐受或選擇不接受加強化療。這些患者被隨機分配接受Mylotarg治療或最好的支持治療,研究終點為總生存期(OS)。結果顯示,接受Mylotarg治療的患者的生存期長於那些只接受支持治療的患者,中位OS分別為4.9個月和3.6個月(HR=0.69 [95%CI: 0.53,-0.90], p=0.05)。第二項試驗是單臂研究,共有57名CD33陽性的經歷一次復發的AML患者。經過單療程Mylotarg治療後,26%的患者達到完全緩解(CR),中位緩解時間達到11.6個月。
使用Mylotarg常見的副作用包括發熱、噁心、感染、嘔吐、出血、血小板水準降低等。較嚴重的副作用會出現低血象、感染、肝損傷、肝靜脈阻塞和嚴重出血等。
“我們在仔細審查了新的給藥方案後批准了Mylotarg。審查表明這種治療的好處超過風險,”FDA腫瘤卓越中心主任兼FDA藥品評價和研究中心的血液學與腫瘤產品辦公室代理主任Richard Pazdur博士說:“Mylotarg的歷史強調了檢查癌症患者治療的替代劑量、用藥安排和用藥管理的重要性,特別是那些最容易受到治療副作用影響的患者。”

▲Richard Pazdur博士表示,FDA認可了這種治療的好處超過風險
“FDA批准Mylotarg填補了許多AML成人和兒童患者未滿足的需求。如果不治療,這一疾病可以在幾個月甚至幾個禮拜致命,而且復發率很高,”輝瑞腫瘤部全球總裁Liz Barrett女士說:“基於臨床資料、實際經驗和AML群體的支持,我們很感激Mylotarg如今有望幫助廣大AML患者。”
Mylotarg曾在2000年作為單獨療法,得到了美國FDA的加速批准,它也是首款獲得批准的抗體藥物偶聯物。然而,後續的臨床試驗未能繼續彰顯這款新藥的療效,安全性上也引起了一些擔憂,因此輝瑞公司曾主動將它撤下市場。在調整了劑量,並補充了更多資料後,這款創新藥物的收益-風險比終於獲得認可,重新上市。我們祝賀輝瑞公司,並感謝新藥研發人員永不言棄的精神,也期待這款新藥可以給AML患者帶來疾病緩解。
